Краткая история химии. Развитие идей и представлений в химии. Большая энциклопедия нефти и газа
В предыдущей главе, вы уже могли заметить, что атомы, группируясь друг с другом, не обязательно образуют двухатомные молекулы, т.е. соединяются в соотношении один к одному. В молекуле воды, например, к одному атома кислорода прикрепляется два атома водорода. Количество связей, которые атом химического элемента образует с другими атомами, называется его валентностью .
Обозначается валентность римскими цифрами — I,II, III и т.д. в соответствии со своим значением. Давайте в качестве примера рассмотрим такие соединения как хлороводород HCl, воду Н 2 О, аммиак NH 3 и метан CH 4 . Смотри рисунок 7.
Рисунок 7. Трехмерные модели молекул HCl (a), H 2 O (б), NH 3 (в) и CH 4 (г)
Если схематично изобразить строение этих молекул, обозначая атомы химических элементов соответствующими им символами, а связь между ними отрезком,
получаются формулы следующего вида, называемые структурными:
 Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Из представленных на рисунке ХХ структурных формул можно сделать вывод о том, что валентность водорода и хлора равна I, кислорода II, азота — III, углерода -IV.
Валентность химических элементов в соединениях принято указывать надстрочным индексом справа от символа химического элемента, либо над ним, как, например, это сделано ниже:
Для некоторых элементов характерна постоянная валентность, то есть в соединениях их валентность равна всегда одному и тому же числу.
Так, например, постоянная валентность, равная единице, наблюдается для ряда металлов, называемых щелочными — лития, натрия, калия, рубидия и цезия, Постоянная валентность, равная двум, наблюдается у кислорода, магния, кальция, стронция, бария, цинка. Постоянная валентность равная трем наблюдается у алюминия Al.
Элементы с переменной валентностью - это элементы, которые в разных соединениях могут иметь различные значения валентности. Следовательно, атомы этих элементов в разных соединениях могут образовывать различное число химических связей (таблица 2).
Таблица 2. Наиболее характерные значения валентности некоторых элементов
| Химические элементы | Их основные валентности |
| Cl, Br, I | I, III, V, VII |
| S, Se | II, IV, VI |
| C, Si, Sn, Pb | II, IV |
| III, V |
|
| I, II |
|
| II, III |
|
| II, III, VI |
Часто в определении валентности таких элементов в каждом отдельном случае может помочь так называемое правило валентности, согласно которому, в соединениях, образованных только двумя химическими элементами практически всегда произведение валентности одного химического элемента на количество его атомов в молекуле равно произведению валентности на количество атомов в молекуле второго элемента. Другими словами для вещества формулу которого в общем виде можно записать как AxBy с валентностями элементов А и В равными n и m соответсвенно, справедливо выражение:
X*n = y*m
Давайте в качестве примера установим валентность серы в соединениях SO 2 (диоксид серы) и Al 2 S 3 (сульфид алюминия). Как уже было сказано выше, кислород и алюминий являются элементами с постоянными валентностями. Для кислорода валентность во всех его соединениях равна двум, а алюминия трем.
Рассчитаем валентность серы в диоксиде серы обозначив ее как «х»:
Аналогично рассчитаем валентность серы в сульфиде алюминия:
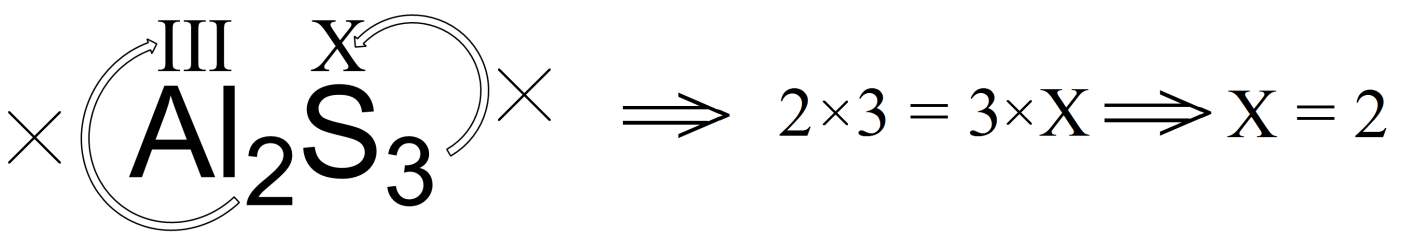
Следует отметить, что правило валентности не применимо для некоторых соединений, в которых есть связи между атомами одного химического элемента. В частности, нельзя использовать правило валентности в случе такого соединения как перекись водорода поскольку его структурную формулу можно записать как Н-О-О-Н, то есть в каждой молекуле данного соединения есть связь кислород-кислород.
Очевидно, что правило валентности может быть использовано не только для нахождения валентности какого-либо элемента, но также и для составления формулы соединения, если известны валентности образующих его элементов.
Рассмотрим в качестве примера следующую задачу:
«Определите формулу соединения образованного атомами хлора и кислорода, если валентность хлора в данном соединении VII »
Решение:
Кислород имеет только одно значение валентности, равное двум, соответственно можем записать:
Наименьшее общее кратное (НОК) чисел 7 и 2 равно 14.
Индекс, относящийся к хлору, будет равен х = 14:7 = 2,
Индекс, относящийся к кислороду, будет равен y = 14:2 = 7.
Т.е. искомая формула Cl 2 O 7 .
Следует отметить тот факт, что в большинстве сложных веществ атомы одного химического друг с другом не связаны, например:
Рисунок 9. Структурные формулы молекул фосфорной кислоты, фосфина, серной кислоты и оксида хлора (VII)
Структурные формулы
Теория валентности сыграла важнейшую роль в развитии теории химии вообще и органической химии в особенности. Исходя из теории валентности, Кекуле предположил, что атом углерода четырехвалентен, и в 1858 г. попытался, опираясь на это предположение, представить строение наиболее простых органических молекул и радикалов . В том же 1858 г. шотландский химик Арчибальд Скотт Купер (1831-1892) предложил изображать силы, соединяющие атомы (или связи , как их принято называть), в виде черточек. После того как была «построена» первая органическая молекула, стало совершенно ясно, почему органические молекулы, как правило, значительно больше и сложнее, чем неорганические.
Согласно представлениям Кекуле, углеродные атомы могут соединяться друг с другом с помощью одной или нескольких из четырех своих валентных связей, образуя длинные цепи - прямые или разветвленные. По-видимому, никакие другие атомы не обладают этой замечательной способностью в той мере, в какой обладает ею углерод.
Итак, представив себе, что у каждого атома углерода четыре валентные связи, а у каждого атома водорода одна такая связь, можно изобразить три простейших углеводорода (соединения, молекулы которых образованы только атомами углерода и водорода), метан CH 4 , этан C 2 H 6 и пропан C 3 H 8 , следующим образом:
Увеличивая число атомов углерода, эту последовательность можно продолжить, причем практически бесконечно. Добавляя к углеводородной цепи кислород (две валентные связи) или азот (три валентные связи), можно представить структурные формулы молекул этилового спирта (C 2 H 6 O) и метиламина (CH 5 N):

Допустив возможность наличия между соседними атомами двух связей (двойная связь ) или трех связей (тройная связь ), можно изобразить структурные формулы таких соединений, как этилен (C 2 H 4), ацетилен (C 2 H 2), метилцианид (C 2 H 3 N), ацетон (C 3 H 6 O) и уксусная кислота (C 2 H 4 O 2):

Полезность структурных формул была настолько очевидной, что многие химики-органики приняли их сразу. Они признали полностью устаревшими все попытки изображать органические молекулы как структуры, построенные из радикалов. В результате было признано необходимым, записывая формулу соединения, показывать его атомную структуру .
Русский химик Александр Михайлович Бутлеров (1823-1886) использовал эту новую систему структурных формул в разработанной им теории строения органических соединений . В 60-х годах прошлого столетия он показал, как с помощью структурных формул можно наглядно объяснить причины существования изомеров (см. гл. 5). Так, например, у этилового спирта и диметилового эфира одна и та же эмпирическая формула C 2 H 6 O, однако структурные формулы этих соединений значительно различаются:

поэтому не удивительно, что изменение в расположении атомов приводит к двум наборам очень разных свойств. В этиловом спирте один из шести атомов водорода присоединен к атому кислорода, в то время как в диметиловом эфире все шесть атомов водорода присоединены к атомам углерода. Атом кислорода удерживает атом водорода слабее, чем атом углерода, так что металлический натрий, добавленный к этиловому спирту, замещает водород (одну шестую общего количества). Натрий, добавленный к диметиловому эфиру, совсем не вытесняет водород. Таким образом, при составлении структурных формул можно руководствоваться химическими реакциями, а структурные формулы, в свою очередь, могут помочь понять суть реакций.
Бутлеров особенно много внимания уделил одному из типов изомерии, называемому таутомерией (динамической изомерией), при которой некоторые вещества всегда выступают как смеси двух соединений. Если одно из этих соединений выделить в чистом виде, оно сразу же частично перейдет в другое соединение. Бутлеров показал, что таутомерия обусловлена спонтанным переходом атома водорода от атома кислорода к соседнему атому углерода (и обратно).
Чтобы вполне доказать справедливость системы структурных формул, необходимо было определить структурную формулу бензола - углеводорода, содержащего шесть атомов углерода и шесть атомов водорода. Сделать это удалось далеко не сразу. Казалось, не существует такой структурной формулы, которая бы, отвечая требованиям валентности, в то же время объясняла бы большую устойчивость соединения. Первые варианты структурных формул бензола очень походили на формулы некоторых углеводородов - соединений весьма нестойких и не похожих по химическим свойствам на бензол.
Решить эту задачу смог опять-таки Кекуле. В один из дней 1865 г. (как он сам рассказывает) Кекуле в полудреме ехал в омнибусе, и ему пригрезилось, что он видит атомы, кружащиеся в танце. Вдруг конец одной цепи соединился с ее началом, и образовалось вращающееся кольцо. И Кекуле решил, что именно такой должна быть структурная формула бензола. До тех пор структурные формулы строились только в виде линейных цепей углеродных атомов, но теперь Кекуле ввел понятие «кольцо» (или «ядро») атомов углерода и предложил следующую структурную формулу бензола:

Это объяснение было принято, и представление о структурных формулах расширилось .
Cтраница 1
Структурная формула показывает, что в молекулах цик-лопарафинов нет двойных связей, за счет которых могло бы лроиюйти присоединение. Последнее, однако, возможно у некоторых циклопарафинов, именно у содержащих три или четыре атома углерода в цикле.
Структурная формула - формула, используемая для изображения молекулы, с указанием связей между атомами. Говорит не только о составе, но и о структуре молекулы, однако не дает представления о пространственном расположении атомов.
Структурные формулы, выведенные на основании химических свойств it реакций органических соединений, могут быть подтверждены синтезом.
Структурная формула показывает лишь, какие атомы соединены друг с другом, но ничего не говорит о их взаимном расположении в пространстве. Формулы I и II указывают лишь, что изображаемая молекула состоит из атома углерода, связанного с двумя атомами водорода и двумя атомами хлора.
Структурные формулы, рассматриваемые в свете электронной теории, могут обладать свободной парой электронов и, таким образом, соединения, соответствующие этим формулам, могут подвергаться атаке электрофиль-ными реагентами; пара электронов, связывающая различные атомы, сдвинута в сторону более электронопритягивающего (электроотрицательного) атома. Связь, таким образом, обладает некоторой степенью полярности и в этом смысле чувствительна к атаке как электрофильных, так и нуклео-фильных реагентов. В хлористом метиле, например, атом углерода обладает частичным положительным зарядом, а атом хлора - частичным отрицательным. Аналогично связь углерод - водород проявляет малую степень полярности.
Структурная формула CnH2nXY есть дерево с п четырехре-берными и 2п 2 концевыми точками. Последние делятся на 3 класса: 2п относятся к атомам Н, одна к X и одна к У. Рассмотрим в этом дереве путь, связывающий X и Y, обозначим через т число С-атомов, которые лежат на этом пути.
Структурная формула такого соединения есть С - Я-граф с числом связности ц (см. разд.
Структурные формулы помогали химикам анализировать структуру некоторых необходимых человеку природных соединении, а затем синтезировать их или похожие на них соединения в своих лабораториях. Редкие, дорогие или добываемые с большим трудом природные вещества можно было легко получать в лаборатории.
Структурные формулы могут описывать не только вариантные конструкции, но и конструкции с изменяющейся структурой во время рабочего процесса.
Структурные формулы выявляют главные, непосредственные связи и сильные химические взаимодействия в молекуле, характеризуя основные особенности ее химического строения и реакционной способности.
Структурная формула представляет собой мгновенное состояние одной цепи или узла в момент срабатывания выходного или промежуточного элемента при воздействии на схему подачей или снятием какого-либо сигнала, например возбуждение этажного реле при нажатии кнопки.
Структурные формулы далеко не отображают всей сложности строения молекулы; они лишь схематически представляют сочетание атомов или ионов по валентности.
Структурная формула и даже само название карб-оксил указывает, что эта группа как бы состоит из карбонильной группы С О и оксигруппы - ОН. Однако кетонный или альдегидный характер, свойственный группе С О, у карбоксила ничем не проявляется. Атомы кислорода в карбоксиле совершенно одинаковы. Это подтверждено изучением физических свойств карбоновых кислот и их рентгеновских спектров.
Структурные формулы, построенные из классических атомных моделей, содержат информацию о посдедовательности атомов в соответствующей молекуле, соединенных ковалентными связями, о кратности этих связей в целочисленном приближении и о пространственных конфигурациях, обусловливающих геометрическую изомерию. Представленные в виде пространственных проекционных формул, они позволяют передавать информацию о стереоизомерии любого типа. Следовательно, каждому индивидуальному органическому соединению соответствует полностью специфическая структурная формула.
Структурные формулы строятся на основании опытов превращения одних органических веществ в другие. Часто бывает необходимо поставить не один опыт, а несколько, иногда довольно сложных. Кроме того, как мы увидим дальше, не всякий опыт оказывается пригодным для вывода формулы строения.