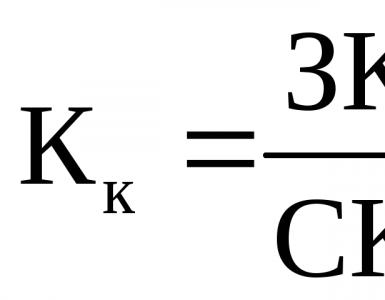Структурная формула молекул
2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков
(японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки
,
например, эсперанто. Среди искусственных языков
выделяются языки
различных наук
. Так, в
химии используется свой, химический язык
.
Химический язык
– система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Однако возможное искажение по отношению к антиконформации угла, которое определяет относительную ориентацию между соседними кольцами и последующую потерю молекулярной планарности, повлияет на электронную структуру полимера, даже если допустить его полезность.
Вот почему, по прошествии многих лет и мощности компьютеров, методы расчета становятся более сложными, чтобы как можно точнее определять потенциалы кручения. Первый подход к знанию конформационных предпочтений политиофена и некоторых его производных может быть достигнут путем изучения очень простого соединения, 2, 2 -битиофена и его диметильных производных. Недавно мы распространили исследование на более крупные тиофеновые олигомеры.
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые " буквы" , научитесь понимать смысл " слов" и" предложений" . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
Эти результаты, которые находятся в ясной синхронизации с экспериментальными наблюдениями, могут быть связаны непосредственно с расширением эффективного сопряжения вдоль полимерной цепи. Процесс допинга: потенциал ионизации и электронной близости. Как обсуждалось выше, легирование полимера связано с его взаимодействием с легирующим агентом и переносом электронов от полимера к легирующей примеси или наоборот. Поэтому важно иметь возможность правильно оценить потенциал ионизации и электронное сродство полимера, которое интересно исследовать.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
Эта величина дает представление о проводящих возможностях полимера, поскольку она представляет собой энергию наиболее благоприятного электронного перехода. Использование этой методики, которая в принципе позволяет воспроизводить характеристики полимерной молекулы бесконечной длины, ограничено молекулами, в которых нет какого-либо типа изменения или молекулярного искажения, поскольку в противном случае оно повторялось бы периодически вдоль цепи. Рассмотрение периодической молекулярной системы обеспечивает логически более точное описание полимера, чем приведенная модель.
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
" чтение" символа, то есть, как этот символ
читается в химической формуле.
Однако последний дает очень разумные результаты с качественной точки зрения и, кроме того, позволяет точно анализировать влияние всех видов изменений и конкретных дефектов в молекуле. Процесс допинга: структурные изменения. Как уже упоминалось, ожидается, что процесс легирования приведет к важным геометрическим изменениям полимерных цепей. К сожалению, аморфная структура, которая характеризует большинство полимеров, значительно усложняет экспериментальное исследование таких изменений. С теоретической точки зрения нейтральную полимерную цепь и электрически заряженную цепь можно моделировать отдельно, чтобы затем проанализировать структурные различия между ними.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Позже, с целью приблизиться к реальным характеристикам политиофена, мы использовали более крупные модели, которые содержали до 13 тиофеновых колец. Результаты подтвердили предыдущие исследования, в то же время позволили определить расширение биполярического дефекта. Другой стратегией исследования структурных изменений является явное моделирование взаимодействия между полимером и легирующим агентом вместо анализа только геометрии исходного и конечного полимерных состояний. Таким образом, исследование включает информацию о площади полимера, в которой происходит взаимодействие с легирующей примесью, а также эффекты поляризации, которые легирующая примесь оказывает на полимер.
Таблица 3. Названия и символы некоторых химических элементов
Название |
||||
Латинское |
Написание |
|||
| - | Написание Новые материалы Несомненно, одно из величайших преимуществ молекулярного моделирования по сравнению с чисто экспериментальными методами заключается в том, что можно «представить» новые материалы и оценить многие их свойства без необходимости их синтезировать с последующей экономией, которую это представляет. Например, можно думать о повышении электропроводности некоторого полимера путем изменения его химического состава или его структуры. Другая важная область исследований сосредоточена на том, как улучшить растворимость полимеров, полученных из политиофена, поскольку это требует некоторые технические приложения. Одним из способов повышения растворимости в органических растворителях является включение определенных функциональных боковых групп, таких как алкильные цепи, ионизируемые заместители, спирты или сложные эфиры, в основную цепь политиофена. С другой стороны, важно знать наиболее благоприятное положение для введения указанных групп, а также тактичность, которую примет полимер. |
Происхождение |
- | - |
| Азот | N itrogenium | От греч. " рождающий селитру" | " эн" | |
| Алюминий | Al uminium | От лат. " квасцы" | " алюминий" | |
| Аргон | Ar gon | От греч. " недеятельный" | " аргон" | |
| Барий | Ba rium | От греч. " тяжелый" | " барий" | |
| Бор | B orum | От арабск. " белый минерал" | " бор" | |
| Бром | Br omum | От греч. " зловонный" | " бром" | |
| Водород | H ydrogenium | От греч. " рождающий воду" | " аш" | |
| Гелий | He lium | От греч. " Солнце" | " гелий" | |
| Железо | Fe rrum | От лат. " меч" | " феррум" | |
| Золото | Au rum | От лат. " горящий" | " аурум" | |
| Йод | I odum | От греч. " фиолетовый" | " йод" | |
| Калий | K alium | От арабск. " щёлочь" | " калий" | |
| Кальций | Ca lcium | От лат. " известняк" | " кальций" | |
| Кислород | O xygenium | От греч. " рождающий кислоты" | " о" | |
| Кремний | Si licium | От лат. " кремень" | " силициум" | |
| Криптон | Kr ypton | От греч. " скрытый" | " криптон" | |
| Магний | M ag nesium | От назв. полуострова Магнезия | " магний" | |
| Марганец | M an ganum | От греч. " очищающий" | " марганец" | |
| Медь | Cu prum | От греч. назв. о. Кипр | " купрум" | |
| Натрий | Na trium | От арабск, " моющее средство" | " натрий" | |
| Неон | Ne on | От греч. " новый" | " неон" | |
| Никель | Ni ccolum | От нем. " медь святого Николая" | " никель" | |
| Ртуть | H ydrarg yrum | Лат. " жидкое серебро" | " гидраргирум" | |
| Свинец | P lumb um | От лат. названия сплава свинца с оловом. | " плюмбум" | |
| Сера | S ulfur | От санскриттского " горючий порошок" | " эс" | |
| Серебро | A rg entum | От греч. " светлый" | " аргентум" | |
| Углерод | C arboneum | От лат. " уголь" | " цэ" | |
| Фосфор | P hosphorus | От греч. " несущий свет" | " пэ" | |
| Фтор | F luorum | От лат. глагола " течь" | " фтор" | |
| Хлор | Cl orum | От греч. " зеленоватый" | " хлор" | |
| Хром | C hr omium | От греч. " краска" | " хром" | |
| Цезий | C aes ium | От лат. " небесно-голубой" | " цезий" | |
| Цинк | Z in cum | От нем. " олово" | " цинк" | |
2.3. Химические формулы
К счастью, упомянутые проблемы могут быть решены с использованием методов молекулярного моделирования. Например, введение карбоксильной группы тиофеновым кольцом может привести к нескольким соединениям, таким как те, которые указаны в описании, структурные и электронные характеристики которых могут быть оценены и сопоставлены с теоретической точки зрения.
Моделирование этих трех соединений указывает на то, что производное с карбоксильными группами в положении 4 тиофеновых колец является наиболее стабильным и принимает конформацию, близкую к плоскостности. Этот результат свидетельствует о том, что оба нейтральных соединения имеют аналогичную электропроводность. В этой статье мы рассмотрели несколько характеристик некоторых гетероциклических полимеров, которые связаны с их способностью проводить электрический ток. Полимеры должны иметь практически плоскую структуру и, по логике, небольшое значение ширины полосы.
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул
.
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие
,
молекулярные
, структурные
и пространственные
.
С другой стороны, низкие ионизационные потенциалы и высокие электронные сродства облегчают легирование полимера. Результаты, представленные в этой статье, показывают, что теоретические методы молекулярного моделирования адекватны для оценки этих и других свойств быстро и относительно легко, позволяя лучше понять явление электрической проводимости.
С другой стороны, важно отметить, что инструменты молекулярного моделирования могут применяться, по крайней мере в принципе, для прогнозирования свойств любого соединения, даже если он никогда не был синтезирован. Следовательно, сотрудничество между теоретической и экспериментальной лабораториями предполагает оптимизацию усилий последних, что может значительно сократить их потребление человеческих и инструментальных ресурсов.
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс " 1" в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород
(Н) и
элемент кислород
(О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц
, в том числе и число атомов
,
обозначается латинской буквой N
. Обозначив
число атомов водорода – N
H , а число
атомов кислорода – N
O , мы можем
записать, что
Грановский, МГУ. В органической химии применяют молекулярные, эмпирические, структурные, полуструктурные и электронные формулы. Молекулярная формула показывает качественный и количественный состав атомов в молекуле. Эмпирическая формула показывает относительное число атомов каждого элемента в молекуле. Структурные и электронные формулы отражают порядок соединения атомов в молекуле. В органической химии обычно пользуются Полуструктурные формулами, поскольку атомы имеют пространственное размещение в молекуле.
Структурные формулы - это язык органической химии. Каждое вещество имеет свою химическую формулу. Однако, были обнаружены вещества, которые имели одинаковые химические формулы, но проявляли различные свойства. Теория строения объяснила причину существования таких соединений. В насыщенных углеводородов атомы углерода могут соединяться последовательно в цепь, поэтому такие углеводороды называют неразветвлёнными. Но для алканов, содержащих четыре и более атомов углерода, возможны другие структуры, которые состоят из разветвленных цепей атомов углерода.
Или N H: N O = 2: 1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.

Существуют два бутаны С 4 Н 10, которые отличаются по физическим свойствам: нормальный бутан СН 3 СН 2 СН 2 СН 3, температура кипения которого 0, 6ºС и бутан разветвленной строения: температура кипения которого 11, 7ºС. Итак, в соединений углерода одна и та молекулярная формула соответствует не одному, а нескольким соединениям, которые отличаются по физическим и химическим свойствам.
Соединения, имеющие одинаковый состав, но различное строение молекул, вызывает различные свойства, называют изомерами, а явление существования таких соединений - изомерией. Наличие изомеров приводит численность органических соединений. Чем больше атомов углерода содержит органическое соединение, тем больше изомеров она образует. Например, для гексана характерные 5 изомеров, гептана - 9, октана - 18 нонана - 35, декану -.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Изомерия в органической химии очень распространена. С ней встречаются при изучении всех классов органических соединений. Изомерию, обусловленную разной последовательностью сообщения атомов в молекулах, а также различным положением кратных связей в них, называют структурной изомерией.
Примером могут служить изомеры бутана. При наличии в молекуле органического соединения четырех атомов углерода возможна изомерия в результате различного размещения атомов углерода. Структурная изомерия в насыщенных углеводородов связана с изомерией карбонового скелета.
Последовательность записи символов элементов в простейших и молекулярных формулах определяется правилами химического языка, с которыми вы познакомитесь по мере изучения химии. На информацию, передаваемую этими формулами, последовательность символов влияния не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (" черточку"). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
С ростом числа атомов углерода в молекуле возрастает число возможных изомеров. Поэтому недостаточно называть только, например, изогексан, которых может быть пять для гексана. Название изомеров должна быть составлена так, чтобы она не только указывала на число атомов, входящих в состав вещества, но и давала представление о структуре его молекулы, чтобы можно было легко и точно написать ее структурную формулу. С этой целью ученые разработали правила составления индивидуальных названий веществ - номенклатуру.
В органической химии для наименования соединений существует несколько номенклатур: историческая или тривиальная, рациональная, систематическая номенклатура. Историческая номенклатура возникла в древности, когда органическим соединениям присваивали случайные названия. В основном эти названия указывали на происхождение веществ. Например, муравьиная, щавелевая, яблочная, винная кислоты, древесный спирт и др. Эта номенклатура не дает возможности называть изомеры.

В молекуле воды атом кислорода связан простыми
(одинарными) связями с двумя атомами водорода, а
атомы водорода между собой не связаны. Именно это
наглядно показывает структурная формула воды.
![]()
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Наиболее удобной является международная номенклатура, в основу которой положен названия насыщенных углеводородов. Для того, чтобы называть изомеры по этой номенклатуре нам сначала необходимо познакомиться с радикалами и заместителями. При отрыве атома водорода от молекул алканов образуются одновалентные частицы, которые называют свободными радикалами.
Радикал - частица, имеет неспаренный электрон и способна к самостоятельному существованию. Названия одновалентных радикалов происходят от названий соответствующих углеводородов с заменой окончания -ан на -ил, -ил. СН 3 метил, -С 4 Н 10 бутил, -С 2 Н 5 этил, -С 6 Н 5 фенил, -С 3 Н 7 пропил, СН = СН 2 винил и др.

Структурная формула фосфорной кислоты показывает, что в молекуле этого вещества один из четырех атомов кислорода связан только с атомом фосфора двойной связью, а атом фосфора, в свою очередь, связан еще с тремя атомами кислорода простыми связями. Каждый из этих трех атомов кислорода, кроме того, связан простой связью с одним из трех имеющихся в молекуле атомов водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
|
|
|
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится " ближе к нам" , а какой " дальше от нас" .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.

Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых веществ: 1) диоксид кремния (кварцевый песок, кварц) SiO 2 – формульная единица состоит из одного атома кремния и двух атомов кислорода; 2) хлорид натрия (поваренная соль) NaCl – формульная единица состоит из одного атома натрия и одного атома хлора; 3) железо Fe – формульная единица состоит из одного атома железа.Как и молекула, формульная единица – наименьшая порция вещества, сохраняющая его химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы |
Информация, передаваемая формулой. |
|
| Простейшая Молекулярная Структурная Пространственная |
|
|
Рассмотрим теперь на примерах, какую информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула

Простейшая формула
говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N
H: N
C:N
O = 1:2:1.
Молекулярная формула
добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула
добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия
.
Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо
.
Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула

1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N
H: N
P:N
O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
| Метан – CH 4 . Если у вас дома есть газовая плита, то с этим веществом вы сталкиваетесь ежедневно: природный газ, который горит в конфорках вашей плиты, на 95 % состоит из метана. Метан – газ без цвета и запаха с температурой кипения –161 o С. В смеси с воздухом он взрывоопасен, этим и объясняются происходящие иногда в угольных шахтах взрывы и пожары (другое название метана – рудничный газ). Третье название метана – болотный газ – связано с тем, что пузырьки именно этого газа поднимаются со дна болот, где он образуется в результате деятельности некоторых бактерий. В промышленности метан используется как топливо и сырье для производства других веществ.Метан является простейшим углеводородом . К этому классу веществ относятся также этан (C 2 H 6), пропан (C 3 H 8), этилен (C 2 H 4), ацетилен (C 2 H 2) и многие другие вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ -
Подобно тому как в неорганической химии основополагающей теоретической базой являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, так в органической химии ведущей научной основой служит теория строения органических соединений Бутлерова-Кекуле-Купера.
Как и любая другая научная теория, теория строения органических соединений явилась результатом обобщения богатейшего фактологического материала, который накопила органическая химия, оформившаяся как наука в начале XIX в. Открывались все новые и новые соединения углерода, количество которых лавинообразно возрастало (табл. 1).
Например, этиловый спирт и диметиловый эфир - изомеры: эти вещества имеют одинаковый состав С 2 Н 6 О, но разное строение, т. е. различный порядок соединения атомов в молекулах, а потому и разные свойства.

Уже известный вам Ф. Вёлер в одном из писем к Й. Я. Берцелиусу так описывал органическую химию: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть...»
Большое влияние на развитие химии оказали работы английского ученого Э. Франкланда, который, опираясь на идеи атомистики, ввел понятие валентность (1853).
В молекуле водорода Н 2 образуется одна ковалентная химическая связь Н-Н, т. е. водород одновалентен. Валентность химического элемента можно выразить числом атомов водорода, которые присоединяет к себе или замещает один атом химического элемента. Например, сера в сероводороде и кислород в воде двухвалентны: H 2 S, или Н-S-Н, Н 2 O, или Н-О-Н, а азот в аммиаке трехвалентен:

В органической химии понятие «валентность» является аналогом понятия «степень окисления», с которым вы привыкли работать в курсе неорганической химии в основной школе. Однако это не одно и то же. Например, в молекуле азота N 2 степень окисления азота равна нулю, а валентность - трем:
![]()
В пероксиде водорода Н 2 O 2 степень окисления кислорода равна -1, а валентность - двум:
![]()
В ионе аммония NH + 4 степень окисления азота равна -3, а валентность - четырем:

Обычно по отношению к ионным соединениям (хлорид натрия NaCl и многие другие неорганические вещества с ионной связью) не используют термин «валентность» атомов, а рассматривают их степень окисления. Поэтому в неорганической химии, где большинство веществ имеют немолекулярное строение, предпочтительнее применять понятие «степень окисления», а в органической химии, где большинство соединений имеют молекулярное строение, как правило, используют понятие «валентность».
Теория химического строения - результат обобщения идей выдающихся ученых-органиков из трех европейских стран: немца Ф. Кекуле, англичанина А. Купера и русского А. Бутлерова.
В 1857 г. Ф. Кекуле отнес углерод к четырехвалентным элементам, а в 1858 г. он одновременно с А. Купером отметил, что атомы углерода способны соединяться друг с другом в различные цепи: линейные, разветвленные и замкнутые (циклические).
Работы Ф. Кекуле и А. Купера послужили основой для разработки научной теории, объясняющей явление изомерии, взаимосвязь состава, строения и свойств молекул органических соединений. Такую теорию создал русский ученый А. М. Бутлеров. Именно его пытливый ум «осмелился проникнуть» в «дремучий лес» органической химии и начать преобразование этой «безграничной чащи» в залитый солнечным светом регулярный парк с системой дорожек и аллей. Основные идеи этой теории впервые были высказаны А. М. Бутлеровым в 1861 г. на съезде немецких естествоиспытателей и врачей в г. Шпейере.
Кратко сформулировать основные положения и следствия теории строения органических соединений Бутлерова-Кекуле-Купера можно следующим образом.
1. Атомы в молекулах веществ соединены в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи (линейные, разветвленные и циклические).
Органические соединения можно расположить в ряды сходных по составу, строению и свойствам веществ - гомологические ряды.
- Бутлеров Александр Михайлович (1828-1886)
, Русский химик, профессор Казанского университета (1857-1868), с 1869 по 1885 г. - профессор Петербургского университета. Академик Петербургской академии наук (с 1874 г.). Создатель теории химического строения органических соединений (1861). Предсказал и изучил изомерию многих органических соединений. Синтезировал многие вещества.
Например, метан СН 4 - родоначальник гомологического ряда предельных углеводородов (алканов). Его ближайший гомолог - этан С 2 Н 6 , или СН 3 -СН 3 . Следующие два члена гомологического ряда метана - пропан С 3 Н 8 , или СН 3 -СН 2 -СН 3 , и бутан С 4 Н 10 , или СН 3 -СН 2 -СН 2 -СН 3 , и т. д.
Нетрудно заметить, что для гомологических рядов можно вывести общую формулу ряда. Так, для алканов эта общая формула С n Н 2n + 2 .
2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
Это положение теории строения органических соединений объясняет явление изомерии. Очевидно, что для бутана С 4 Н 10 , помимо молекулы линейного строения СН 3 -СН 2 -СН 2 -СН 3 , возможно также и разветвленное строение:

Это уже совершенно новое вещество со своими индивидуальными свойствами, отличными от свойств бутана линейного строения.
Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют нормальным бутаном (н-бутаном), а бутан, цепь атомов углерода которого разветвлена, называют изобутаном.

Существует два основных типа изомерии - структурная и пространственная.
В соответствии с принятой классификацией различают три вида структурной изомерии.
Изомерия углеродного скелета. Соединения отличаются порядком расположения углерод-углеродных связей, например рассмотренные н-бутан и изобутан. Именно этот вид изомерии характерен для алканов.
Изомерия положения кратной связи (С=С, С=С) или функциональной группы (т. е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений), например:

Межклассовая изомерия . Изомеры этого вида изомерии относятся к разным классам органических соединений, например рассмотренные выше этиловый спирт (класс предельных одноатомных спиртов) и диметиловый эфир (класс простых эфиров).
Различают два вида пространственной изомерии: геометрическую и оптическую.
Геометрическая изомерия характерна, прежде всего, для соединений с двойной углерод-углеродной связью, так как по месту такой связи молекула имеет плоскостное строение (рис. 6).

Рис. 6.
Модель молекулы этилена
Например, для бутена-2, если одинаковые группы атомов у атомов углерода при двойной связи находятся по одну сторону от плоскости С=С-связи, то молекула является цисизомером, если по разные стороны - трансизомером.

Оптической изомерией обладают, например, вещества, молекулы которых имеют асимметрический, или хиральный, атом углерода, связанный с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням, и не совместимы. (Теперь вам, очевидно, стало понятным второе название этого вида изомерии: греч. хирос - рука - образец несимметричной фигуры.) Например, в виде двух оптических изомеров существует 2-оксипропановая (молочная) кислота, содержащая один асимметрический атом углерода.

У хиральных молекул возникают изомерные пары, в которых молекулы изомеров относятся по своей пространственной организации одна к другой так же, как соотносятся между собой предмет и его зеркальное отображение. Пара таких изомеров всегда обладает одинаковыми химическими и физическими свойствами, за исключением оптической активности: если один изомер вращает плоскость поляризованного света по часовой стрелке, то другой - обязательно против. Первый изомер называют правовращающим, а второй - левовращающим.
Значение оптической изомерии в организации жизни на нашей планете очень велико, так как оптические изомеры могут существенно отличаться как по своей биологической активности, так и по совместимости с другими природными соединениями.
3. Атомы в молекулах веществ влияют друг на друга. Взаимное влияние атомов в молекулах органических соединений вы рассмотрите при дальнейшем изучении курса.
Современная теория строения органических соединений основывается не только на химическом, но и на электронном и на пространственном строении веществ, которое подробно рассматривается на профильном уровне изучения химии.
В органической химии широко используют несколько видов химических формул.
Молекулярная формула отражает качественный состав соединения, т. е. показывает число атомов каждого из химических элементов, образующих молекулу вещества. Например, молекулярная формула пропана: С 3 Н 8 .
Структурная формула отражает порядок соединения атомов в молекуле согласно валентности. Структурная формула пропана такова:

Часто нет необходимости детально изображать химические связи между атомами углерода и водорода, поэтому в большинстве случаев используют сокращенные структурные формулы. Для пропана такую формулу записывают так: СН 3 -СН 2 -СН 3 .
Строение молекул органических соединений отражают с помощью различных моделей. Наиболее известны объемные (масштабные) и шаростержневые модели (рис. 7).

Рис. 7.
Модели молекулы этана:
1 - шаростержневая; 2 - масштабная
Новые слова и понятия
- Изомерия, изомеры.
- Валентность.
- Химическое строение.
- Теория строения органических соединений.
- Гомологический ряд и гомологическая разность.
- Формулы молекулярные и структурные.
- Модели молекул: объемные (масштабные) и шаростержневые.
Вопросы и задания
- Что такое валентность? Чем она отличается от степени окисления? Приведите примеры веществ, в которых значения степени окисления и валентности атомов численно одинаковы и различны,
- Определите валентность и степень окисления атомов в веществах, формулы которых Сl 2 , СО 2 , С 2 Н 6 , С 2 Н 4 .
- Что такое изомерия; изомеры?
- Что такое гомология; гомологи?
- Как, используя знания об изомерии и гомологии, объяснить многообразие соединений углерода?
- Что понимают под химическим строением молекул органических соединений? Сформулируйте положение теории строения, которое объясняет различие в свойствах изомеров, Сформулируйте положения теории строения, которые объясняют многообразие органических соединений.
- Какой вклад внес каждый из ученых - основоположников теории химического строения - в эту теорию? Почему ведущую роль в становление этой теории сыграл вклад русского химика?
- Возможно существование трех изомеров состава С 5 Н 12 , Запишите их полные и сокращенные структурные формулы,
- По представленной в конце параграфа модели молекулы вещества (см, рис. 7) составьте его молекулярную и сокращенную структурную формулы.
- Рассчитайте массовую долю углерода в молекулах первых четырех членов гомологического ряда алканов.