На что разлагается h2co3. Соли угольной кислоты. Применение солей угольной кислоты
Диоксид углерода постоянно образуется в природе при окислении органических веществ (гниение растительных и животных остатков, дыхание, сжигание топлива). В больших количествах он выделяется из вулканических трещин и из вод минеральных источников.
В лабораториях диоксид углерода обычно получают, действуя на мрамор соляной кислотой в аппарате Киппа:
В промышленности большие количества диоксида углерода получают при обжиге известняка:
Диоксид углерода при обычных условиях - бесцветный газ, примерно в 1,5 раза тяжелее воздуха, благодаря чему его можно переливать, как жидкость, из одного сосуда в другой. Масса при нормальных условиях составляет 1,98 г. Растворимость диоксида углерода в воде невелика: 1 объем воды при растворяет 0,88 объема , а при объема. Применяется диоксид углерода при получении соды по аммиачпо-хлоридному способу (см. стр. 426), для синтеза карбамида (стр. 427), для получения солей угольной кислоты, а также для газирования фруктовых и минеральных вод и других напитков.
Под давлением около диоксид углерода при комнатной температуре превращается в жидкость. Жидкий диоксид углерода хранят в стальных баллонах. При быстром выливании его из баллона поглощается вследствие испарения так много теплоты, что превращается в твердую белую снегообразную массу, которая, не плавясь, сублимируется при . Твердый диоксид углерода под названием «сухой лед» применяется для охлаждения скоропортящихся продуктов, для производства и сохранения мороженого, а также во многих других случаях, когда требуется получение низкой температуры.
Раствор в воде имеет кисловатый вкус и обладает слабокислой реакцией, обусловленной присутствием в растворе небольших количеств угольной кислоты , образующейся в результате обратимой реакции:
Таким образом, диоксид углерода является ангидридом угольной кислоты.
Равновесие последней реакции сильно сдвинуто влево лишь очень небольшое количество растворенного превращается в угольную кислоту.
Угольная кислота может существовать только в водном растворе. При нагревании раствора диоксид углерода улетучивается, равновесие образования смещается влево, и в конце концов остается чистая вода.
Угольная кислота очень слабая. В растворе она диссоциирует главным образом на ионы и и лишь в ничтожном , честве образует ионы :
Константа диссоциации угольной кислоты по первой ступени, учитывающая равновесие ионов со всем количеством диоксида углерода в растворе (как в форме , так и в виде угольной кислоты), выражается соотношением:
![]()
Константа диссоциации по второй ступени;

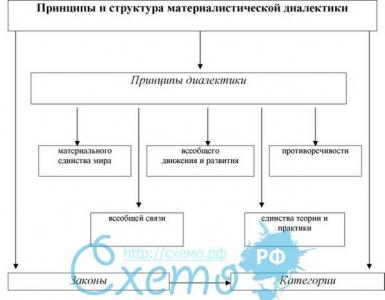
Как двухосновная кислота, угольная кислота образует два ряда солей - средние и кислые; средние соли называются карбонатами, кислые - гидрокарбонатами.
Соли угольной кислоты могут быть получены или действием диоксида углерода на щелочи, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:

Со слабыми основаниями угольная кислота в большинстве случаев дает только основные соли, примером которых может служить карбонат гидроксомеди . Встречающийся в природе минерал такого состава называется малахитом.
При действии кислот, даже таких слабых, как уксусная, все карбонаты разлагаются с выделением диоксида углерода. Этой реакцией часто пользуются для открытия карбонатов, так как выделение легко обнаружить по характерному шипению.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением . Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов, например:
![]()
Гидрокарбонаты щелочных металлов при нагревании переходят в карбонаты:
Большинство гидрокарбонатов, а также карбонаты калия, натрия, рубидия, цезия и аммония растворимы в воде; карбонаты других металлов в воде нерастворимы.
Растворы карбонатов щелочных металлов вследствие гидролиза имеют сильнощелочную реакцию
Из солей угольной кислоты в природе чрезвычайно распространен карбонат кальция . Он встречается в виде известняка, мела, мрамора.
Карбонат кальция нерастворим в воде. Поэтому известковая вода (раствор гидроксида кальция) при пропускании через нее диоксида углерода мутнеет:
Однако, если пропускать через известковую воду долгое время, то мутная вначале жидкость постепенно светлеет и наконец становится совершенно прозрачной. Растворение происходит вследствие образования кислой соли - гидрокарбоната кальция:
Гидрокарбонат кальция - вещество непрочное. При кипячении раствора или продолжительном его стоянии на воздухе гидрокарбонат разлагается с выделением и образованием средней соли.
Растворимостью гндрокарбонатов в воде объясняется постоянное передвижение карбонатов в природе. Почзенные и грунтовые воды, содержащие , просачиваясь сквозь почву и особенно сквозь пласты известняка, растворяют карбонат кальция и уносят его с собой в виде гидрокарбоната в ручьи, реки и моря. Оттуда он попадает в организмы морских животных и идет на построение их скелетов или, выделяя диоксид углерода, снова превращается в карбонат кальция и отлагается в виде пластов.
Кроме карбоната кальция, в природе встречается в больших количествах карбонат магния , известный под названием магнезита. Карбонат магния, как и карбонат кальция, легко растворяется в воде, содержащей , переходя в растворимый гидрокарбонат.
Некоторые карбонаты являются ценными рудами и служат для получения металлов (например, шпатовый железняк , галмей ).
Карбонат натрия, или сода, . В виде кристаллогидрата сода отвечает формуле . Однако этот кристаллогидрат легко выветривается - теряет часть кристаллизационной воды.
Сода - один из главных продуктов основной химической промышленности. Она в больших количествах потребляется стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтяной и другими отраслями промышленности, а также служит для получения различных солей натрия. Применяется сода и в быту, главным образом как моющее средство.
В настоящее время соду получают в промышленности аммиачно-хлоридным способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе.
Концентрированный раствор хлорида натрия насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка.
При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония
который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия:
Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают.
При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь поступающий в производство:
Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак
который также возвращается в производство.
Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение.
Полученный по аммначно-хлоридному способу карбонат натрия не содержит кристаллизационой воды и называется кальцинированной содой.
Часть гидрокарбоната натрия используется без дальнейшей переработки. Например, под названием питьевой, или двууглекислой, соды он применяется в медицине, в хлебопечении, в пищевой промышленности.
Производство кальцинированной соды в СССР непрерывно растет. В 1957 г. оно составило . т, примерно втрое превысив объем производства 1940 г., а в 1985 г. достигло .
Карбонат калия, или поташ, представляет собой белый порошок, расплывающийся во влажном воздухе и хорошо растворимый в воде. Применяется он для получения мыла, при изготовлении тугоплавкого стекла, в фотографии. Поташ получают действием диоксида углерода на раствор гидроксида калия, образующийся при электролизе раствора хлорида калия:
Важное в практическом отношении соединение - карбамид, или мочевина, получается взаимодействием диоксида углерода с аммиаком под давлением:
Этот способ получения карбамида был открыт в 1870 г., А. И. Базаровым.
Карбамид представляет собой белые кристаллы, хорошо растворимые в воде. Он используется в сельском хозяйстве в качестве высококонцентрированного азотного удобрения и как добавка к корму жвачных животных. На основе карбамида получают дешевые пластические массы, так называемые карбамидные пластики. Он служит также исходным материалом для получения многих органических веществ и лекарственных препаратов. Некоторые производные карбамида обладают гербицидными свойствами - они применяются для борьбы с сорняками.
Чем больше человек узнает об окружающем его мире, тем больше осознает ограниченность и несовершенство своих знаний. Возьмем, к примеру, газированную воду. Как известно, данный напиток отличается от других тем, что в нем содержится в небольших дозах угольная кислота, которая сразу же начинает распадаться, как только мы открутим пробку на бутылке. Поэтому у нас не вызывает сомнений утверждение в учебнике химии о том, что данное вещество является крайне неустойчивым. В газовой фазе оно очень быстро превращается в смесь обычной воды и привычного углекислого газа. Однако, как показали последние исследования, с этим вполне можно поспорить. Но вначале давайте вспомним, что представляет собой данное вещество.
Что такое угольная кислота?
Формула этого химического соединения выглядит довольно просто: Н 2 СО 3 . Наличие двух атомов водорода указывает на то, что эта кислота является двухосновной, а ее неустойчивость говорит о ее слабости. Как известно, в воде происходит диссоциация кислот, и рассматриваемое соединение не подпадает под исключение. Впрочем, здесь есть одна особенность: из-за наличия двух оснований данный процесс происходит в два этапа:
H 2 СО 3 ↔ Н + + НСО 3 - ,
НСО 3 - ↔ Н + + СО3 2- .
При взаимодействии с сильным основанием угольная кислота образовывает нормальные или кислые карбонаты. Последние отличаются тем, что у них замещается не два, а всего лишь один атом водорода. Ярким примером нормального карбоната является стиральная сода (Na 2 CO 3), а роль образца гидрокарбоната может играть пищевая сода (NaHCO 3).
Что удалось обнаружить ученым?
При протонировании безводного бикарбоната калия (КНСО 3) при температуре -110 o C водород выбивает атом К. В результате получается очень чистая угольная кислота. Позже был найден еще более легкий способ - нагрев в вакууме NH 4 HCO 3 . В результате такого разложения бикарбоната аммония выделяется аммоний и формируется безводная угольная кислота. Последняя проявляет удивительную стабильность при сублимации в вакууме. Когда ученые начали исследовать данный парадокс, оказалось, что причина кроется в значении энергетического барьера. Для безводного соединения Н 2 СО 3 он составляет 44 ккал/моль, а когда есть вода, его величина оказывается почти в два раза ниже - 24 ккал/моль. Так что при соответствующих условиях угольная кислота вполне может пребывать в свободном виде. Впрочем, данное открытие интересно не только с точки зрения теории химии. Его практическая ценность в том, что оно позволило по-новому изучить процесс дыхания. Теперь ученые считают, что формирование в живом организме угольной кислоты ускоряется при помощи особого фермента, и как раз это и позволяет быстро удалять углекислый газ из клеток сначала в кровь, а затем в легкие.  Данным открытием также не преминули воспользоваться астрономы: свободное состояние углекислоты позволило им провести ее спектральный анализ, и теперь это соединение можно будет идентифицировать в атмосфере окружающих нас планет. Все это наводит на мысль о том, что в мире еще полно различных тайн и секретов. Похоже, современные учебники не раз придется переписывать, уточняя старые и открывая новые знания.
Данным открытием также не преминули воспользоваться астрономы: свободное состояние углекислоты позволило им провести ее спектральный анализ, и теперь это соединение можно будет идентифицировать в атмосфере окружающих нас планет. Все это наводит на мысль о том, что в мире еще полно различных тайн и секретов. Похоже, современные учебники не раз придется переписывать, уточняя старые и открывая новые знания.

Общие сведения Угольная кислота́ слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.



Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:

Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода

Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора

Органические производные Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот. Некоторые представители подобных соединений перечислены в таблице. Класс соединений Пример соединения Сложные эфиры поликарбонаты Хлорангидридыфосген Амидымочевина Нитрилыциановая кислота Ангидридыпироугольная кислота