Какой из металлов имеет больший радиус атома. Размеры атомных радиусов металлов
Атомным ионам; имеют смысл радиусов сфер, представляющих эти атомы или ионы в молекулах или кристаллах. Атомные радиусы позволяют приближённо оценивать межъядерные (межатомные) расстояния в молекулах и кристаллах.
Электронная плотность изолированного атома быстро убывает по мере увеличения расстояния до ядра, так что радиус атома можно было бы определить как радиус той сферы, в которой сосредоточена основная часть (например, 99%) электронной плотности. Однако для оценки межъядерных расстояний оказалось удобнее интерпретировать атомные радиусы иначе. Это привело к появлению различных определений и систем атомных радиусов.
Ковалентный радиус атома Х определяют как половину длины простой химической связи Х—Х. Так, для галогенов ковалентные радиусы вычисляются из равновесного межъядерного расстояния в молекуле Х 2 , для серы и селена - в молекулах S 8 и Se 8 , для углерода - в кристалле алмаза. Исключение составляет атом водорода, для которого ковалентный атомный радиус принимается равным 30 пм, тогда как половина межъядерного расстояния в молекуле Н 2 равна 37 пм. Для соединений с ковалентным характером связи, как правило, выполняется принцип аддитивности (длина связи Х—Y примерно равна сумме атомных радиусов атомов Х и Y), что позволяет предсказывать длины связей в многоатомных молекулах.
Ионные радиусы определяют как величины, сумма которых для пары ионов (например, Х + и Y -) равна кратчайшему межъядерному расстоянию в соответствующих ионных кристаллах. Существует несколько систем ионных радиусов; системы различаются численными значениями для отдельных ионов в зависимости от того, какой радиус и какого иона принят за основу при вычислении радиусов других ионов. Например, по Полингу - это радиус иона О 2- , принятый равным 140 пм; по Шеннону - радиус того же иона, принятый равным 121 пм. Несмотря на эти различия, разные системы при вычислении межъядерных расстояний в ионных кристаллах приводят к примерно одинаковым результатам.
Металлические радиусы определяют как половину кратчайшего расстояния между атомами в кристаллической решётке металла. Для структур металла, различающихся типом упаковки, эти радиусы различны. Близость значений атомных радиусов различных металлов часто служит указанием на возможность образования этими металлами твёрдых растворов. Аддитивность радиусов позволяет предсказывать параметры кристаллических решёток интерметаллических соединений.
Ван-дер-ваальсовы радиусы определяют как величины, сумма которых равна расстоянию, на которое могут сблизиться два химически не связанных атома разных молекул или разных групп атомов одной и той же молекулы. В среднем ван-дер-ваальсовы радиусы примерно на 80 пм больше, чем ковалентные радиусы. Ван-дер-ваальсовы радиусы используют для интерпретации и предсказания стабильности конформаций молекул и структурного упорядочения молекул в кристаллах.
Лит.: Хаускрофт К., Констебл Э. Современный курс общей химии. М., 2002. Т. 1.
ОСНОВЫ ФИЗИЧЕСКОЙ ХИМИИ СПЛАВОВ
Конспект лекций
Составитель доцент кафедры ТФиХОМ,
к.т.н., доцент Чумаченко Г.В.
СТРОЕНИЕ СПЛАВОВ. МЕТАЛЛОХИМИЧЕСКИЕ СВОЙСТВА
ЭЛЕМЕНТОВ
Сплав – это вещество, полученное сплавлением (возможно спеканием, электролизом, возгонкой) двух или более элементов.
Если в твердом состоянии отсутствует химическое взаимодействие между элементами и они не способны к взаимному растворению, то строение сплава является механической смесью зерен обоих компонентов.
Вещества, составляющие сплав, могут вступать в химическое взаимодействие, образуя химические соединения , или взаимно растворяться друг в друге, образуя растворы . В сплавах возможно образование промежуточных фаз, которые не относятся ни к химическим соединениям, ни к растворам.
Важнейшими факторами, определяющими характер взаимодействия металлов между собой и с неметаллами, являются:
Размеры атомных радиусов металлов;
Положение металлов в ряду электроотрицательности элементов;
Валентность и ионизационный потенциал элементов.
Все эти свойства зависят от положения элементов в периодической системе. Применительно к взаимодействию металлов по определению И.И. Корнилова их называют металлохимическими свойствами элементов.
Для определения характера взаимодействия и возникающих при этом типах химической связи растворов (жидких и твердых) и соединений металлов необходимо рассматривать металлохимические свойства элементов только во взаимосвязи, а не по отдельности.
Размеры атомных радиусов металлов
Многие реакции между металлами и металлов с металлоидами отличаются от обычных химических реакций атомным характером, образованием растворов и соединений в кристаллическом состоянии с характерным типом металлической и ковалентной связи между атомами. Поэтому большое значение имеют межатомные расстояния, определяемые атомными радиусами элементов.
Каждому атому соответствует сфера действия определенного радиуса, называемая атомным радиусом , который представляет собой минимальное расстояние, на которое центры сфер одних атомов приближаются к поверхности сфер других атомов.
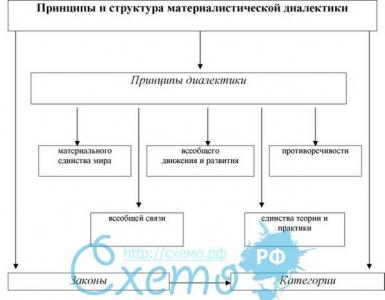
Атомные радиусы, как и многие другие свойства элементов, имеют строгую периодическую зависимость от атомного номера элемента. На рис. 1 представлены значения атомных радиусов элементов по группам элементов периодической системы. В этом рисунке элементы бериллий, бор и алюминий расположены во II и III группах подгруппы В, где они показывают большую последовательность изменения атомного радиуса, чем в подгруппе А.
Рис. 1. Атомные радиусы элементов по группам периодической системы
По значениям атомных радиусов все элементы могут быть разделены на три семейства. Одно из них охватывает элементы со средними значениями атомных радиусов, а два других крайних семейства - элементы с максимальными и минимальными значениями этого свойства.
При рассмотрении рис. 1 можно отметить следующие характерные особенности: наибольшие значения атомных радиусов имеют металлы I и II групп подгруппы А с малыми атомными номерами, относящиеся к наиболее типичным металлам; наименьшие значения относятся к типичным легким металлоидам (B, C, N, O, Н) – элементы III-VII групп подгруппы В. Тяжелые металлы III-V групп Подгруппы В с большими атомными номерами (In, Tl, Sn, Pb, Sb, Bi) показывают увеличение размеров атомных радиусов по мере возрастания атомных номеров. Металлы, относящиеся к группе переходных элементов (III-VIII) с незаполненной d-электронной оболочкой, а также металлы I и II групп подгруппы В имеют средние значения атомных радиусов.
Последовательность изменения атомного радиуса элементов по группам заключается в уменьшении его размера по мере уменьшения атомного номера элемента данной группы.
Сходство или различие атомных радиусов элементов в связи с другими свойствами атомов имеет решающее значение для взаимодействия металлов, в частности для реакций образования соединений.
АТОМНЫЕ РАДИУСЫ
эффективные характеристики атомов, позволяющие приближенно оценивать межатомное (межъядерное) расстояние в молекулах и кристаллах. Согласно представлениям квантовой механики, атомы не имеют четких границ, однако вероятность найти электрон, связанный с данным ядром, на определенном расстоянии от этого ядра быстро убывает с увеличением расстояния. Поэтому атому приписывают нек-рый радиус, полагая, что в сфере этого радиуса заключена подавляющая часть электронной плотности (90-98%). А. р. - величины очень малые, порядка 0,1 нм, однако даже небольшие различия в их размерах могут сказываться на структуре построенных из них кристаллов, равновесной конфигурации молекул и т. п. Опытные данные показывают, что во мн. случаях кратчайшее расстояние между двумя атомами действительно примерно равно сумме соответствующих А. р. (т. наз. принцип аддитивности А. р.). В зависимости от типа связи между атомами различают металлич., ионные, ковалентные и ван-дер-ваальсовы А. р. Металлич. радиус равен половине кратчайшего расстояния между атомами в кристаллич. структуре металла. Его значение зависит от координац. числа К(числа ближайших соседей атома в структуре). Чаще всего встречаются структуры металлов с К= 12. Если принять значение А. р. в таких кристаллах за 1, то А. р. металлов с К,
равными 8, 6 и 4, составят соотв. 0,98, 0,96 и 0,88. Близость значений А. р. разл. металлов - необходимое (хотя и недостаточное) условие того, что эти металлы образуют твердые р-ры замещения. Так, жидкие К и Li (радиусы 0,236 и 0,155 нм соотв.) обычно не смешиваются, а К с Rb и Cs образуют непрерывный ряд твердых р-ров (радиусы Rb и Cs-соотв. 0,248 и 0,268 нм). Аддитивность металлич. А. р. позволяет с умеренной точностью предсказывать параметры кристаллич. решеток интерметаллич. соединений. Ионные радиусы используют для приближенных оценок кратчайших межъядерных расстояний в ионных кристаллах, предполагая, что эти расстояния равны сумме соответствующих ионных радиусов атомов. Существует неск. систем значений ионных радиусов, отличающихся для индивидуальных ионов, но приводящих к примерно одинаковым межъядерным расстояниям в ионных кристаллах. Впервые ионные радиусы были определены в 20-х гг. 20 в. В. М. Гольдшмидтом, опиравшимся на рефрактометрич. значения радиусов F - и О 2- , равных соотв. 0,133 и 0,132 нм. В системе Л. Полинга за основу принято значение радиуса иона О 2- , равное 0,140 нм, в распространенной системе Н. В. Белова и Г. Б. Бокия радиус этого же иона принят равным 0,136 нм, в системе К. Шеннона -0,121 нм (К = 2). Ковалентный радиус равен половине длины одинарной хим. связи XЧX, где Х - атом неметалла. Для галогенов ковалентный А. р. - это половина межъядерного расстояния в молекуле Х 2 , для S и Se- в Х 8 , для С-в кристалле алмаза. Ковалентные радиусы F, Cl, Br, I, S, Se и С равны соотв. 0,064, 0,099, 0,114, 0,133, 0,104, 0,117 и 0,077 нм. Ковалентный радиус водорода принимают равным 0,030 нм, хотя половина длины связи НЧН в молекуле Н 2 равна 0,037 нм. Пользуясь правилом аддитивности А. р., предсказывают длины связей в многоатомных молекулах. Напр., длины связей СЧН, СЧF и СЧС1 должны составлять 0,107, 0,141 и 0,176 нм соотв., и они действительно примерно равны указанным значениям во мн. орг. молекулах, не содержащих кратных углерод-углеродных связей; в противном случае соответствующие межъядерные расстояния уменьшаются. Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т. е. принадлежащими разным молекулам, напр. в молекулярных кристаллах. Значения ван-дер-ваальсовых радиусов находят, пользуясь принципом аддитивности А. р., из кратчайших контактов соседних молекул в кристаллах. В среднем они на ~ 0,08 нм больше ковалентных радиусов. Знание ван-дер-ваальсовых радиусов позволяет определять конформацию молекул и их упаковку в молекулярных кристаллах. Энергетически выгодными обычно бывают такие конформации молекул, в к-рых перекрывание ван-дер-ваалъсовых радиусов валентно не связанных атомов невелико. Ван-дер-ваальсовы сферы валентно связанных атомов в пределах одной молекулы перекрываются. Внеш. контур перекрывающихся сфер определяет форму молекулы. Молекулярные кристаллы подчиняются принципу плотной упаковки, согласно к-рому молекулы, моделируемые своим "ван-дер-ваальсовым окаймлением", располагаются т. обр., что "выступы" одной молекулы входят во "впадины" другой. Пользуясь этими представлениями, можно интерпретировать кристаллографич. данные, а в ряде случаев и предсказывать структуру молекулярных кристаллов. Лит.:
Боки и Г. Б., Кристаллохимия, 3 изд., М., 1971, с. 136-41; Полинг Л., По лин г П., Химия, пер. с англ., М., 1978; Современная кристаллография, т. 2, М., 1979, с. 67-88. В. Г. Дашевский.